La séquestration splanchnique
"Une approche innovante pour lutter contre la dénutrition et la sarcopénie"
Auteur Jans TOLHOWIGH
Experts
Avec l’allongement de la longévité, l’Homme est exposé à davantage de phénomènes pathologiques chroniques. La modification de la composition corporelle (ratio masse musculaire/masse graisseuse) est une des plus reconnaissable, du moins visuellement. Dit autrement, avec l’avancée en âge l’augmentation de sa masse grasse se fait au détriment du muscle22. Même si l’on conserve un poids stable, cela ne veut pas pour autant dire que la composition corporelle, elle, ne change pas !
Mais pourquoi l’avancée en âge se lie systématiquement à un fonte musculaire ?
Dans une étude intéressante26, Buford et ses collègues se sont penchés sur des modèles d'accélération de la fonte musculaire et tenter des explications sur les dommages atrophiques des muscles liés à l’âge. Le graphique ci-dessous décrit le taux accéléré de sarcopénie via divers comportements et maladies représentés sur la base des estimations recensées dans la littérature.
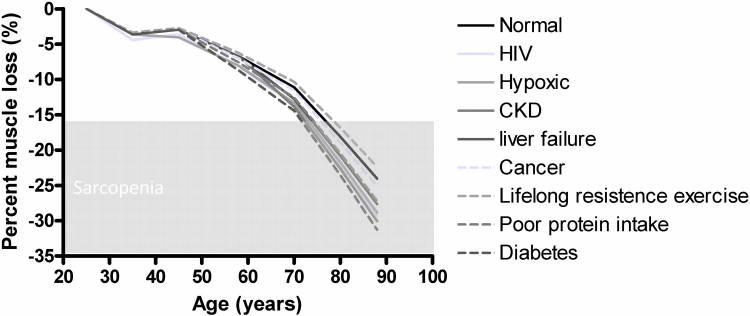
- VIH (début à 35 ans) : 22% plus élevé27,
- Conditions hypoxiques (début ∼60 ans) : 20% de plus28,29,30,31,32,33,34
- Chronic Maladie rénale (apparition ∼70 ans) : 25% de plus35,
- Insuffisance hépatique (apparition ∼70 ans) : 15% de plus36,
- Cancer (apparition ∼60 ans) : 4,5% plus élevé37,
- Faible apport en protéines (début ∼60 ans) : 13% plus grand38
- DM (début ∼60 ans) : 30% plus grand39,
- Pratique tout au long de la vie d'exercices contre résistance (début ∼25 ans) : 7% de moins.
La figure ci-dessus laisse supposer que le déclin moyen de la masse musculaire est de ∼1,5% par an après l'âge de 50 ans40.
La fonte musculaire, et in fine la perte de force, est multifactorielle. En effet, en fonction de son terrain physiologique, des contraintes musculaires que l’on inflige à son corps, de son état de stress, de ses habitudes de vies, c’est tout un ensemble métabolique qui sera impacté et qui lui-même aura un impact sur la composition corporelle.
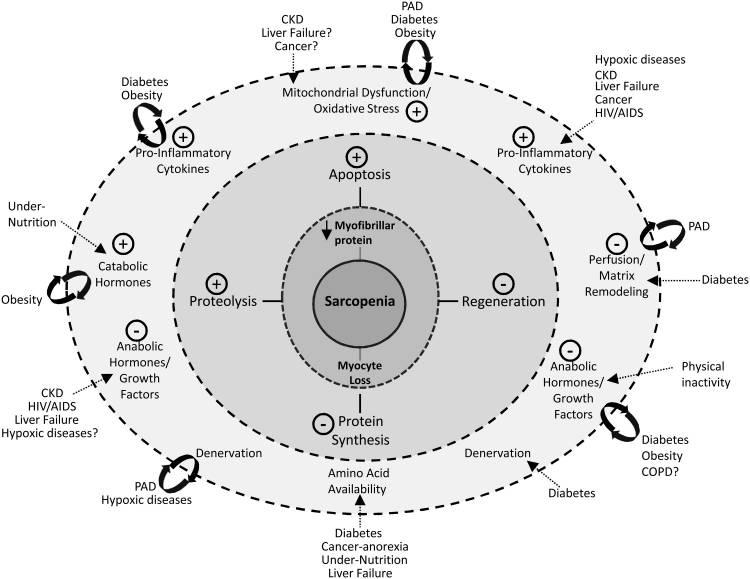
Les mécanismes associés à une sarcopénie accélérée en raison de conditions et de comportements pathologiques
Bien que le vieillissement contribue à la présence de ces mécanismes liés à l'atrophie, ces comportements et maladies améliorent leur activité. La figure ci-contre doit être lue de l'extérieur vers l'intérieur ce qui conduit finalement à une perte de protéines myocytaires et myofibrillaires. Les signes plus (+) indiquent une régulation positive et les signes négatifs (-) correspondent à une régulation négative d'une voie spécifique. La figure représente une approche progressive de la façon dont certaines conditions et comportements pathologiques peuvent moduler quatre des principales voies mécanistes impliquées dans la sarcopénie : l'apoptose, la protéolyse, la régénération et la synthèse des protéines. Cette figure n'est pas destinée à être exhaustive ou détaillée (c'est-à-dire une voie de signalisation) et peut donc être sujette à une fausse représentation en raison de la complexité des interactions impliquées dans les conditions multidimensionnelles. Cependant, le modèle est dessiné pour illustrer les interactions qui servent à nourrir les principales voies qui accélèrent la sarcopénie. Ces interactions comprennent, mais sans s'y limiter, des changements dans les cytokines pro-inflammatoires, les hormones anaboliques, la dénervation, la fonction mitochondriale et la perfusion sanguine tissulaire. Certaines voies ont des propriétés de rétroaction où l'étiologie de la maladie aggrave la condition (par exemple, la dénervation aggrave la perfusion musculaire dans le PAD). PAD -maladie artérielle périphérique-, CKD -maladie rénale chronique-.
Réduisons le champ d'observation
Après avoir décrit en avant propos la relation âge/sarcopénie, nous allons, dans cet article nous intéresser à un effet physiologique incontournable lié à l'âge et quelles stratégies nous pouvons mettre en place afin de, non pas l’éviter, mais d’en minimiser les effets sur les muscles.
La masse musculaire est intimement liée la synthèse des protéines musculaires. L’augmentation de la synthèse protéique va dépendre de deux facteurs majeurs : la contrainte mécanique exercée sur les muscles (entraînement, quantité et intensité des charges, etc…), qui va entraîner leur dégradation temporaire, et la disponibilité des facteurs liés à leur reconstruction. Ce dernier facteur est essentiellement apporté par une alimentation adaptée et notamment par l’apport suffisant de protéines de haute qualité, c’est-à-dire ayant un aminogramme complet et équilibré.
Les protéines musculaires sont donc synthétisées à partir des protéines contenues dans les aliments.
Ce qui commence à l’état d’un bon steak, d’un fromage blanc ou d’un verre de lait est décomposé en une vingtaine de briques de construction différentes que l’on appelle acides aminés. Ces acides aminés passent dans le sang et sont disponibles pour la construction des muscles. Tous les acides aminés n’ont en revanche pas le même impact sur la synthèse protéique mais ont un rôle synergique couvrant l’ensemble du processus métabolique.
L’entraînement de force et la prise d’un repas à haute teneur en acides aminés favorisent tous deux la synthèse des protéines.
Pour info
La leucine est un acide aminé de premier plan qui va stimuler la synthèse protéique musculaire car il active le complexe 1 de la protéine kinase mTOR - cible mammalienne de la rapamycine - (mTORC1).
Les mécanismes de l’entraînement de force et l’ingestion d’acides aminés activent la mTOR différemment. Par conséquent, leurs effets sont additifs. Autrement dit, l’entraînement et l’ingestion d’acides aminés ont un effet plus important quand ils ont lieu en même temps plutôt que séparément.
La stimulation de la synthèse des protéines musculaires après un repas ou un exercice s’accompagne d’une augmentation de la phosphorylation et, probablement, de l’activité de la voie de signalisation du mTOR, incluant la protéine kinase S6 ribosomale 70-kDa (S6K1) et sa protéine ribosomale S6 cible (rpS6). Le rôle majeur du complexe 1 mTOR (mTORC1) dans la régulation de la masse musculaire en réponse à une large variété d’entrées en amont, incluant les nutriments, les facteurs de croissance et l’insuline, a été établi depuis longtemps.
Nous avons évoqué jusqu’à présent la partie liée à la construction du muscle. Pour autant, le cycle cellulaire d’un muscle est en permanence rythmé par des phases anaboliques (construction) et des phases cataboliques (destruction). Par exemple, lors de l’entraînement le catabolisme musculaire est en forte augmentation, tout comme dans les périodes de jeûne ou d’apports nutritionnels incomplets. La phase de repos et d’alimentation donne le départ à un nouveau cycle anabolique. Ces périodes s’alternent tout au long de notre vie et notre métabolisme a recours à un complexe processus de “turnover” protéique.
Si durant la première partie de notre vie, les phases anaboliques sont globalement plus importantes que les phases cataboliques, dès notre vingtième année les choses sont amenées à changer et plus les années passent plus notre potentiel destructif prend le pas sur nos aptitudes à reconstruire. C’est le vieillissement !
S’il s’agit d’un phénomène inexorable, nous pouvons néanmoins en atténuer les effets et surtout ralentir sa progression.
Pour info
Pour quantifier le ratio synthèse/dégradation protéique en jeu dans notre organisme, nous avons longtemps eu recours au bilan azoté. Un équilibre positif pour la synthèse serait qualifié d' “anabolique”, par opposition à une dégradation plus importante qui serait considérée comme “catabolique”. Ce processus est à l’image de tout le cycle de vie des cellules de l’organisme ; une alternance RED-OX (Réduction-Oxydation).
Les acides aminés qui constituent les protéines et des peptides possèdent des atomes d’Azote, qui sert la mesure la plus utilisée pour quantifier la teneur protéinée des aliments.
La technique du bilan azoté se réduit à quantifier l’azote consommé et l’azote excrété via les urines (méthode de Kjeldahl) ; où un bilan azoté positif résulte en PS (Protein synthesis) > PB (proteine breakdown), un neutre PS = PB et un bilan négatif PS < PB.
L’anabolisme musculaire est donc directement lié à la disponibilité des acides aminés en circulation afin d’activer la synthèse protéique. Une alimentation suffisamment protéinée est donc essentielle, mais pas que ! Pourquoi ? Parce qu’un phénomène physiologique intervient comme un trouble fête ; la séquestration splanchnique.
Peu connue du grand public, la séquestration splanchnique est la rétention de certains métabolites circulants (comme les acides aminés) par les viscères, principalement le foie et les intestins. Les acides aminés sont les briques de construction des protéines. Ils ne passent plus dans le sang en quantité suffisante : certains d’entre eux sont retenus à hauteur de 90%. Privés de leurs matières premières, les muscles fondent, s’atrophient. Quant au foie, il s’engorge des déchets azotés (urée, acides lactique et uriques). La séquestration splanchnique touche toutes les personnes (hommes ou femmes, sportives ou sédentaires, malades ou en bonne santé) après 50 ans et se trouve doublée dès 70 ans.

Il semble donc que l’âge contribue à la séquestration splanchnique de certains acides aminés dont un en particulier, la leucine, ce qui pourrait être un facteur clé de la sarcopénie chez les personnes âgées1. On estime chez les personnes âgées de plus de 70 ans que 50% des protéines ingérées au cours d’un repas sont retenu sous forme d’acides aminés par le foie et l’intestin contre 25% chez les adultes.
Les mécanismes responsables de la sarcopénie (fonte de la masse musculaire avec l'âge) restent mal connus. Le primum movens semble être une moindre réponse anabolique du muscle à la prise alimentaire. Cette dernière peut être liée à une moindre disponibilité systémique en acides aminés, en rapport avec une augmentation de leur utilisation par les territoires splanchniques. Cette séquestration splanchnique peut être saturée par l'augmentation des apports protéiques (globaux ou d'acides aminés particulièrement concernés), par une modification du rythme des apports, ou encore par l'utilisation de protéines rapidement digestibles. Alternativement (ou de façon complémentaire), l'anomalie pourrait siéger au niveau musculaire par diminution des stimuli anaboliques (insuline, GH, testostérone...) ou par augmentation des agents cataboliques (cortisol, cytokines pro-inflammatoires...).
Quelles sont donc les stratégies à adopter chez les séniors ?
Les stratégies proposées ici ne sont ni exclusives, ni exhaustives et peuvent utilisées de façon concomitante en gardant toutefois à l’esprit que quelque soit l’intérêt de la stratégie, elle ne peut être envisagée qu’au regard des bénéfices, au sens large, qu’elle peut apporter.
Première stratégie possible
Le régime protéique pulsé, aussi appelé chrono nutrition protéique, consiste à concentrer un apport protéique important sur un repas, soit 80 % des apports journaliers recommandés, évalués à 1,4 à 1,8 grammes par kilogramme de masse corporelle et par jour chez la personne âgée. Cet apport permettrait de saturer partiellement l’extraction splanchnique (c’est-à-dire une rétention des acides aminés alimentaires par l’intestin et le foie pour leurs besoins propres) afin d’obtenir une meilleure biodisponibilité des acides aminés pour la stimulation de la synthèse protéique musculaire postprandiale. Une étude21 a proposer en un seul repas, en l'occurrence le déjeuner, 70 % à 80 % de l'apport protéique quotidien afin que l'organisme puisse en disposer en quantité suffisante. Réalisée sur 66 personnes d'un âge moyen de 85 ans — toutes dénutries et hospitalisées —, l'étude a comparé deux groupes recevant la même quantité de protéines (1,3 g) et d'énergie (33 kcal) par kilo de poids corporel. Le premier sous forme de régime « pulse », l'autre standard (20 % des protéines le matin, 30 % à midi, 20 % au goûter et 30 % au dîner). Après six semaines, les seniors du groupe « pulse » ont pris en moyenne un kilo de masse maigre (muscle) quand ceux du groupe « standard » ont peiné à garder un poids stable.
Deuxième stratégie possible
Une supplémentation en L-citruline. La L-citrulline est un acide aminé non protéique, c’est-à-dire qu’il ne rentre pas dans la composition des protéines. C’est également un effecteur des métabolismes protéique et énergétique. La L-citrulline est le seul acide aminé à ne pas être capté par le foie (contrairement aux autres acides aminés), ce qui lui permet d’échapper à l’extraction splanchnique. La consommation de 3,5 g de L-citrulline permet d’atteindre une citrullinémie comprise entre 650 et 900 µmol/L. Cette citrullinémie a été associée à une augmentation de 25 % de la vitesse de synthèse protéique musculaire chez l’Homme2. Ce puissant effet sur la synthèse protéique musculaire se déroule via la voie mTORC141.
Chez la personne âgée, 10 grammes de citrulline par jour permet d’augmenter de 5 à 10 % la masse musculaire3 et d’améliorer les performances physiques (Amélioration des performances physiques en EHPAD.). Dans le même sens, chez des seniors de plus de 60 ans sarcopéniques (et obèses), 10 g de L-citrulline par jour pendant 3 mois, associés à un entraînement physique, est plus efficace pour augmenter la force musculaire et la fonction musculaire que l’entraînement physique sans association avec la citrulline4. Et dans une population de seniors plus hétérogènes, il a aussi été démontré que cette association entraînement physique et citrulline était plus bénéfique aux personnes qui consomment moins de 1g/kg/j de protéines que chez celles consommant plus de 1g/kg/j de protéines5.
Troisième stratégie possible
Une supplémentation en leucine ou en protéines rapides. La Leucine est un acide aminé qui joue un rôle primordial dans la synthèse des protéines musculaires. Elle est un puissant activateur de la synthèse protéine musculaire via son action sur la voie mTOR9. Des études suggèrent qu’une complémentation en leucine au moment du repas permet d’augmenter la synthèse protéique musculaire10, 17. Cependant, plusieurs études, dont des méta-analyses, montrent que chez les personnes âgées, un enrichissement en leucine sur le long terme ne permet pas d’augmenter la force ou la fonction musculaire11, 12, 13. Ceci est peut-être dû au fait que la leucine est séquestrée dans l’aire splanchnique et n’arrive pas en assez grande quantité au niveau des muscles.
Une étude a montré qu’il fallait doubler la proportion de leucine pour obtenir une synthèse protéique musculaire23. Cependant des études longitudinales sur des modèles animaux n’ont pas montré une augmentation de l’accumulation protéique due à la supplémentation en leucine en l’absence d’autres acides aminés24, 25. La vitesse d’absorption des protéines peut jouer un rôle important dans la biodisponibilité postprandiale des acides aminés et donc avoir une incidence sur la stimulation de la synthèse protéique musculaire14. Dans ce contexte, plus l’apparition des acides aminés dans le sang est massive et rapide, plus l’aire splanchnique a des chances d’être saturée. Les protéines rapides comme celles du lactosérum sont riches en leucine. Une étude a montré que chez le sujet âgé l’ingestion de protéines rapides (telle que les protéines de lactosérum) permet un meilleur gain protéique post-prandial que l’ingestion de protéines lentes (telle que la caséine), à l’inverse de ce qui est observé chez le sujet jeune15. Cependant, là encore, des études montrent qu’une complémentation en protéines rapides chez des personnes âgées augmente la synthèse protéique musculaire16. Les données concernant sur une amélioration de la fonction musculaire restent encore controversées18 même si les données semblent prometteuses19.
Petit complément !
Les acides gras à chaîne moyenne pourraient optimiser les effets de la leucine sur la fonction musculaire dans une population âgée particulièrement à risque de sarcopénie. Parmi les acides aminés indispensables, la leucine fait l’objet d’un intérêt grandissant en prévention de la sarcopénie. Pour lui permettre d’être utilisée préférentiellement pour la synthèse protéique plutôt que pour la production énergétique, des chercheurs ont testé les effets des triglycérides à chaîne moyenne (TCM) – dont l’oxydation mitochondriale musculaire est rapide et prioritaire – en les ajoutant à l’alimentation de personnes âgées fragiles (n = 11 H et 27 F ; 86,6 ans) d’un établissement de soins japonais. Dans le cadre d’une étude randomisée20 contrôlée de 3 mois, ces patients recevaient ainsi un comprimé de 1,2 g de leucine + 20 µg de vitamine D, ainsi que 6 g de TCM (LD + TCM ; n = 13) ou 6 g de triglycérides à longue chaîne (LD + TCL ; n = 13). Un groupe témoin ne recevait aucune supplémentation (n = 12). En termes de force et d’endurance musculaires, le groupe LD + TCM présentait une augmentation de la force de préhension de la main droite plus élevée (p < 0,05) que le groupe témoin (+ 1,2 kg soit 13,1 % en 3 mois, p < 0,01), ainsi qu’un temps de maintien des genoux en extension plus élevé (p < 0,05) que le groupe LD + TCL. Les mesures de la fonction locomotrice étaient également améliorées par rapport au groupe LD + TCL, avec notamment une vitesse de marche augmentée de 12,5 % en 3 mois dans le groupe LD + TCM. Les résultats étaient plus incertains pour la masse musculaire (pas de mesure directe et absence de différences des circonférences des mollets et des bras). On trouve des TMC en quantité importante (60%) dans l’huile de coco.
Stratégie associée
Une complémentation en vitamine D. La vitamine D n’a pas montré d’efficacité sur la sarcopénie mais sur la réduction (de 19 à 23 %) du nombre de chutes liées à la faiblesse musculaire chez les personnes de plus de 65 ans6. Il est conseillé chez les personnes âgées de consommer 800 à 1000 UI minimum de vitamine D3 par jour (soit 20 µg, en pratique, cela peut être une dose de 100 000 UI tous les 3 mois) de façon à maintenir un bon niveau de vitamine D. Ceci est important car il est maintenant connu que la concentration sanguine de vitamine D est positivement associée à la vitesse de marche7. Cependant, une méta-analyse regroupant 15 études indique qu’une supplémentation en vitamine D ne permet pas d’augmenter la force musculaire8.
Conclusion
Le vieillissement s’accompagne d’une perte progressive d’autonomie physique et d’une augmentation de l’invalidité. Le vieillissement affecte donc de manières différentes les organes et les tissus de l'organisme, aboutissant à des vitesses différentes d'apparition de déclin fonctionnel. Ainsi, le vieillissement s'accompagne d'une perte de masse et de fonction musculaires survenant de la maturité à la sénescence et définissant la sarcopénie. Le processus de vieillissement désensibilise les muscles par rapport aux protéines, ce qui entraîne une plus grande exigence par repas pour atteindre les niveaux de leucine. On estime que les personnes âgées ont besoin de protéines de bonne qualité à une dose d’environ 40gr pour une réponse anabolique maximale.
La dénutrition protéino-énergétique, qui touche une partie de la population âgée, accentue leur déclin musculaire (sarcopénie et dynapénie - perte de fonction musculaire) et participe donc à l’augmentation de la morbi-mortalité. La prévention et le traitement de la dénutrition s’avèrent difficiles, lié au défaut de réponse à la renutrition observé chez les personnes âgées ; celui-ci est expliquépar une forte extraction splanchnique des acides aminés en période post-prandiale, responsable d’une moindre stimulation de la protéosynthèse musculaire. La séquestration splanchnique des acides aminés est un processus observé pendant le vieillissement et qui entraîne une diminution de la disponibilité des acides aminés périphériques (AA). Les mécanismes sous-jacents à la séquestration splanchnique des acides aminés restent incertains mais le couple primo-prévention nutritionnelle et fonctionnelle semble la seule alternative viable et garantissant le retard d'entrée dans la dépendance, l'amélioration de la qualité de vie et la limitation de la morbi-mortalité liée à la dynapénie.
Conflit d'intérêts
Le.s auteur.s déclare.nt n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Référence
[1] Am J Clin Nutr February 1997 vol. 65 no. 2 489-495, Boirie et al., "Splanchnic and whole-body leucine kinetics in young and elderly men"
[2] Citrulline stimulates muscle protein synthesis in the post-absorptive state in healthy people fed a low-protein diet – A pilot study. Clin Nutr. 2015 June ; 34(3): 449–456. doi:10.1016/j.clnu.2014.04.019. Marion Jourdan, K. Sreekumaran Nair, Rickey E. Carter, Jill Schimke, G. Charles Ford, Julie Marc, Christian Aussel, and Luc Cynober. https://www.citrage.com/p/citrulline/synthese-musculaire
[3] Clinical nutrition September 2015Volume 34, Supplement 1, Pages S17–S18 OR042: Effects of Citrulline (CIT) Oral Supplementation During 21 Days on Body Composition in Malnourished Elderly Patients O. Bouillanne, J.-C. Melchior, C. Faure, F. Canouï-Poitrine, M. Paul, Y. Boirie, B.Dérick, D. Chevenne, C. Forasassi, E. Guery E, S. Herbaud, P. Le Corvoisier, N. Neveux, V. Nivet Antoine, A.Astier, A. Raynaud-Simon, E. Valiente, S. Walrand, L. Cynober, C. Aussel https://www.citrage.com/p/citrulline/masse-musculaire-personnes-agees
[4] Journal of clinical medecine. Effect of High-Intensity Interval Training Combinedwith L-Citrulline Supplementation on FunctionalCapacities and Muscle Function in Dynapenic-ObeseOlder AdultsFanny Buckinx1,2, Gilles Gouspillou1,2, Livia P. Carvalho1,2, Vincent Marcangeli1,2,Guy El Hajj Boutros1,2, Maude Dulac2, Philippe Noirez1,3, JoséA. Morais4,Pierette Gaudreau5and Mylène Aubertin-Leheudre. https://www.citrage.com/p/citrulline/citrulline-force-musculaire-vitesse-marche-seniors-obesite-sarcopenique
[5] Nutrients 2019, 11(7), 1685; https://doi.org/10.3390/nu11071685 Initial Dietary Protein Intake Influence Muscle Function Adaptations in Older Men and Women Following High-Intensity Interval Training Combined with Citrulline by Fanny Buckinx, Vincent Marcangeli, Lívia Pinheiro Carvalho, Maude Dulac, Guy Hajj Boutros, Gilles Gouspillou, Pierrette Gaudreau, José Morais, Philippe Noirez and Mylène Aubertin-Leheudre https://www.citrage.com/p/citrulline/citrulline-entrainement-physique-seniors-proteines
[6] Bischoff-Ferrari HA, Dawson-Hughes B et Staehelin HB, Orav JE, Stuck AE, Theiler R, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ, 2009, Vol. 339 b3692.
[7] Annweiler C, Henni S2, Walrand S et al. Vitamin D and walking speed in older adults: Systematic review and meta-analysis. Maturitas. 2017;106:8-25.
[8] Rosendahl-Riise H, Spielau U, Ranhoff AH. Vitamin D supplementation and its influence on muscle strength and mobility in community-dwelling older persons: a systematic review and meta-analysis. J Hum Nutr Diet. 2017;30(1):3-15.
[9] Guillet C, Zangarelli A, Mishellany A, Rousset P et Sornet C, Dardevet D, et al. Mitochondrial and sarcoplasmic proteins, but not myosin heavy chain, are sensitive to leucine supplementation in old rat skeletal muscle.Exp. Gerontol, 2004 mai, Vol. 39(5),745.
[10] Rieu I, Sornet C, Bayle G, Prugnaud J, Pouyet C et Balage M,et al. Leucine-supplemented meal feeding for ten days beneficially affects postprandial muscle protein synthesis in old rats.J. Nutr, 2003 avr, Vol. 133(4),1198-205.
[11] Verhoeven S, Vanschoonbeek K, Verdijk LB et al. Long-term leucine supplementation does not increase muscle mass or strength in healthy elderly men. 2009. Am J Clin Nutr. 89(5):1468-75.
[12] Leenders M, Verdijk LB, van der Hoeven L et al. Prolonged leucine supplementation does not augment muscle mass or affect glycemic control in elderly type 2 diabetic men. 2011. J Nutr. 141(6):1070-6.
[13] Xu ZR, Tan ZJ, Zhang Q et al. The effectiveness of leucine on muscle protein synthesis, lean body mass and leg lean mass accretion in older people: a systematic review and meta-analysis. Br J Nutr. 2015. 113:25-34.
[14] Boirie Y, Dangin M, Gachon P, Vasson MP, Maubois JL, Beaufrère B. Slow and fast dietary proteins differently modulate postprandial protein accretion. Proc. Natl. Acad. Sci. U.S.A. 1997 déc 23;94(26):14930-5.
[15] Dangin M, Guillet C, Garcia-Rodenas C, Gachon P, Bouteloup-Demange C, Reiffers-Magnani K, et al. The rate of protein digestion affects protein gain differently during aging in humans. J. Physiol. (Lond.) 2003 juin 1;549(Pt 2):635-44.
[16] Devries MC, McGlory C1, Bolster DR et al. Protein leucine content is a determinant of shorter- and longer-term muscle protein synthetic responses at rest and following resistance exercise in healthy older women: a randomized, controlled trial. 2018. Am J Clin Nutr. 107(2):217-226.
[17] Rieu I, Balage M, Sornet C, Giraudet C, Pujos E et Grizard J, et al. Leucine supplementation improves muscle protein synthesis in elderly men independently of hyperaminoacidaemia.J. Physiol. (Lond.), 2006 août 15, Vol. 575(Pt 1),305-15.
[18] ISPOGLOU T Double-blind, placebo-controlled pilot trial of L-Leucine-enriched amino-acid mixtures on body composition and physical performance in men and women aged 65-75 years. Eur J Clin Nutr 2016, 70, 182-188
[19] BAUER JM Effects of a vitamin D and leucine-enriched whey protein nutritional supplement on measures of sarcopenia in older adults, the provide study: a randomized, double-blind, placebo-controlled trial. JAMDA 2015, 16, 740-747
[20] J Nutr. 2016 May;146(5):1017-26. doi: 10.3945/jn.115.228965. Epub 2016 Apr 13. Medium-Chain Triglycerides in Combination with Leucine and Vitamin D Increase Muscle Strength and Function in Frail Elderly Adults in a Randomized Controlled Trial. Abe S, Ezaki O, Suzuki M
[21] Clin Nutr. 2013 Apr;32(2):186-92. doi: 10.1016/j.clnu.2012.08.015. Epub 2012 Aug 30. Impact of protein pulse feeding on lean mass in malnourished and at-risk hospitalized elderly patients: a randomized controlled trial. Bouillanne O, Curis E, Hamon-Vilcot B, Nicolis I, Chrétien P, Schauer N, Vincent JP, Cynober L, Aussel C.
[22] Adult lean body mass declines with age: some longitudinal observations. Forbes GB, Reina JC Metabolism. 1970 Sep; 19(9):653-63.
[23] Am J Physiol Endocrinol Metab. 2006 Aug;291(2):E381-7. Epub 2006 Feb 28. A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. Katsanos CS1, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR.
[24] J Anim Sci. 1987 Jun;64(6):1664-71. Amino acid excesses for young pigs: effects of excess methionine, tryptophan, threonine or leucine. Edmonds MS, Baker DH.
[25] Am J Physiol Endocrinol Metab. 2002 Oct;283(4):E824-35. Tissue-specific effects of chronic dietary leucine and norleucine supplementation on protein synthesis in rats. Lynch CJ1, Hutson SM, Patson BJ, Vaval A, Vary TC.
[26] Ageing Res Rev. 2010 Oct;9(4):369-83. doi: 10.1016/j.arr.2010.04.004. Epub 2010 May 14. Models of accelerated sarcopenia: critical pieces for solving the puzzle of age-related muscle atrophy. Buford TW1, Anton SD, Judge AR, Marzetti E, Wohlgemuth SE, Carter CS, Leeuwenburgh C, Pahor M, Manini TM.
[27] Quantitative assessment of cross-sectional muscle area, functional status, and muscle strength in men with the acquired immunodeficiency syndrome wasting syndrome. Grinspoon S, Corcoran C, Rosenthal D, Stanley T, Parlman K, Costello M, Treat M, Davis S, Burrows B, Basgoz N, Klibanski À J Clin Endocrinol Metab. 1999 Jan; 84(1):201-6.
[28] Cytokines and neurohormones relating to body composition alterations in the wasting syndrome of chronic heart failure. Anker SD, Ponikowski PP, Clark AL, Leyva F, Rauchhaus M, Kemp M, Teixeira MM, Hellewell PG, Hooper J, Poole-Wilson PA, Coats AJ Eur Heart J. 1999 May; 20(9):683-93.
[29] Calf muscle adaptation to peripheral vascular disease. Clyne CA, Mears H, Weller RO, O'Donnell TF Cardiovasc Res. 1985 Aug; 19(8):507-12.
[30] Peripheral muscle weakness contributes to exercise limitation in COPD. Gosselink R, Troosters T, Decramer M
[31] Effects of exercise training on insulin-like growth factor-I expression in the skeletal muscle of non-cachectic patients with chronic heart failure. Hambrecht R, Schulze PC, Gielen S, Linke A, Möbius-Winkler S, Erbs S, Kratzsch J, Schubert A, Adams V, Schuler G Eur J Cardiovasc Prev Rehabil. 2005 Aug; 12(4):401-6. Am J Respir Crit Care Med. 1996 Mar; 153(3):976-80.
[32] Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease. Marquis K, Debigaré R, Lacasse Y, LeBlanc P, Jobin J, Carrier G, Maltais F Am J Respir Crit Care Med. 2002 Sep 15; 166(6):809-13.
[33] Lower extremity ischemia, calf skeletal muscle characteristics, and functional impairment in peripheral arterial disease. McDermott MM, Hoff F, Ferrucci L, Pearce WH, Guralnik JM, Tian L, Liu K, Schneider JR, Sharma L, Tan J, Criqui MH J Am Geriatr Soc. 2007 Mar; 55(3):400-6.
[34] Chronic changes in skeletal muscle histology and function in peripheral arterial disease. Regensteiner JG, Wolfel EE, Brass EP, Carry MR, Ringel SP, Hargarten ME, Stamm ER, Hiatt WR Circulation. 1993 Feb; 87(2):413-21.
[35] Atrophy of non-locomotor muscle in patients with end-stage renal failure. Sakkas GK, Ball D, Mercer TH, Sargeant AJ, Tolfrey K, Naish PF Nephrol Dial Transplant. 2003 Oct; 18(10):2074-81.
[36] Activation of ubiquitin-proteasome pathway is involved in skeletal muscle wasting in a rat model with biliary cirrhosis: potential role of TNF-alpha. Lin SY, Chen WY, Lee FY, Huang CJ, Sheu WH Am J Physiol Endocrinol Metab. 2005 Mar; 288(3):E493-501.
[37] Review Pathogenesis of cancer cachexia. Tisdale MJ J Support Oncol. 2003 Sep-Oct; 1(3):159-68.
[38] Dietary protein intake is associated with lean mass change in older, community-dwelling adults: the Health, Aging, and Body Composition (Health ABC) Study. Houston DK, Nicklas BJ, Ding J, Harris TB, Tylavsky FA, Newman AB, Lee JS, Sahyoun NR, Visser M, Kritchevsky SB, Health ABC Study. Am J Clin Nutr. 2008 Jan; 87(1):150-5.
[39] Excessive loss of skeletal muscle mass in older adults with type 2 diabetes. Park SW, Goodpaster BH, Lee JS, Kuller LH, Boudreau R, de Rekeneire N, Harris TB, Kritchevsky S, Tylavsky FA, Nevitt M, Cho YW, Newman AB, Health, Aging, and Body Composition Study. Diabetes Care. 2009 Nov; 32(11):1993-7.
[40] Age-associated changes in skeletal muscles and their effect on mobility: an operational diagnosis of sarcopenia. Lauretani F, Russo CR, Bandinelli S, Bartali B, Cavazzini C, Di Iorio A, Corsi AM, Rantanen T, Guralnik JM, Ferrucci L J Appl Physiol (1985). 2003 Nov; 95(5):1851-60.
[41] Moinard C, Nicolis I, Neveux N, Darquy S, Bénazeth S, Cynober L (2008) Dose-ranging effects of citrulline administration on plasma amino acids and hormonal patterns in healthy subjects: the Citrudose pharmacokinetic study. Br J Nutr 99:855–86
Les derniers articles du blog !
Tous les articles liés à "La séquestration splanchnique"

La sarcopénie, l'âge et la perte de muscle
La sarcopénie se définit comme un processus de perte progressive et générale de la force et de la masse musculaire. Les études s'accordent pour dire que la dégénerescence musculaire survient dès l'âge de 30 ans à raison d'une perte musculaire moyenne pouvant varier de 3 à 8% tous les dix ...
