Rôle de la méthionine dans le processus de vieillissement
Et si la longévité ne trouvait pas directement son explication dans la pratique jeûne ou de la restriction calorique ?
Auteur Jans TOLHOWIGH
Experts
Depuis toujours l’Homme s’est passionné pour les secrets de la longévité. De façon plus contemporaine, la longévité semble avoir une étroite corrélation avec une relative frugalité alimentaire. En effet, on a constaté des affinités entre les régions du monde où les habitants sont habitués à s’alimenter avec modération et une espérance de vie plus importante. De ces corrélations, certains n'hésitent pas à crier à qui veut l'entendre que la restriction alimentaire, diminuant ainsi la production de radicaux libres et d'hormone de croissance, serait le garant d'une espérance de vie accrue. Au regard de la science rien indique pourtant que la frugalité ne garantisse une plus grande espérance de vie. Pour autant, l'impact des habitudes alimentaires reste significatif, c'est pourquoi la recherche s'est intéressée au lien qu'il pouvait y avoir entre l'espérance de vie et la consommation de protéines. Les protéines étant des polymères d'acides aminés, c'est plus particulièrement sur la méthionine que les chercheurs ont porté leur attention. C'est au travers de ce prisme que nous allons établir notre réflexion.
La méthionine est un acide aminé qui est à la fois nécessaire, a minima, et délétère si sa consommation est majorée. Nous allons voir dans cet article comment la méthionine intervient dans le métabolisme et quelles sont les conditions de maintien de son équilibre.
Présentation
La méthionine est un acide aminé soufré essentiel, c’est-à-dire que notre corps ne peut pas le métaboliser. Il faut donc recourir à l’alimentation pour couvrir ses besoins journaliers. C’est dans les viandes maigres animales que la concentration de méthionine est la plus élevée. Les blancs d’oeufs renferment à eux seuls 3 204mg de méthionine pour 100g.Pour couvrir les besoins journaliers, on recommande un apport en méthionine équivalent à une fourchette située entre 20mg / kg de poids de corps et 40mg / kg de poids de corps. Pour une personne de 70kg, ceci représente l’équivalent de 1400mg à 2800mg. Avec trois oeufs, à raison d’environ 900mg de méthionine par oeuf moyen, l’apport maximal est couvert. Une portion de viande musculaire de 150gr apporte environ 1200mg de méthionine.
Intervention biochimique de la méthionine
La méthionine intervient directement dans la biosynthèse des protéines et, de ce fait, est à la base même de toute structure protéique via le processus de méthylation. Ce processus métabolique vital a lieu en permanence dans toutes les cellules de notre organisme. C’est ce procédé qui permet à lui seul d’assurer une multitude de fonctions dans le corps humain. Il permet notamment la modulation de l’expression de certains gènes de notre ADN via des processus épigénétiques. Les gènes ne sont que des prédispositions. La capacité des gènes à s’exprimer, ou non, en fonction du mode de vie, dépendra ainsi entièrement de la méthylation. D’après l’INSERM, “La génétique correspond à l’étude des gènes, l’épigénétique s’intéresse à une « couche » d’informations complémentaires qui définit comment ces gènes vont être utilisés par une cellule ou… ne pas l’être.”34En résumé, l’une des fonctions principales de la méthionine est d’initier la méthylation en tant que “donneur de méthyl”, accélérant ou stabilisant les réactions chimiques du corps.
Interrogations sur une alimentation distributrice de méthionine
Dans nos sociétés, nous venons de voir que les apports quotidiens permettent largement de couvrir les besoins. Mais qu’en est-il pour les personnes amenées à consommer des protéines animales à chaque repas ? Dans le cas d’une personne consommant 3 oeufs le matin puis 1 portion de viande à midi et 1 portion de poisson le soir, nous arrivons à un total estimé de 5200mg de méthionine par jour, ce qui correspond au taux maximum conseillé pour une personne de 130kg. Il s’agit-là d’une consommation courante chez la plupart des sportifs voir minimale, et particulièrement chez les adeptes de la musculation.Il devient alors légitime de se demander ce qu’un apport aussi important pourrait avoir sur l’organisme.
Pour que la méthylation soit enclenchée, la méthionine doit se combiner à une molécule d’ATP afin qu’elle ai une forme métaboliquement active. Cette nouvelle forme s’appelle la S-adénosyl-L-méthionine, ou SAM. Avec la méthylation elle libère sa molécule d’APT et se transforme en S-adénosyl-L-homocystéine ou SAH qui donnera lieu à un produit de métabolisation, l’homocystéine5.
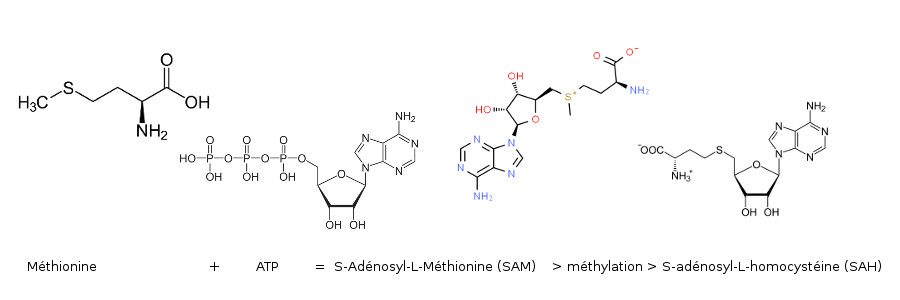
Une fois l’homocystéine produite, l’organisme va utiliser 3 voies métaboliques pour la recycler rapidement.
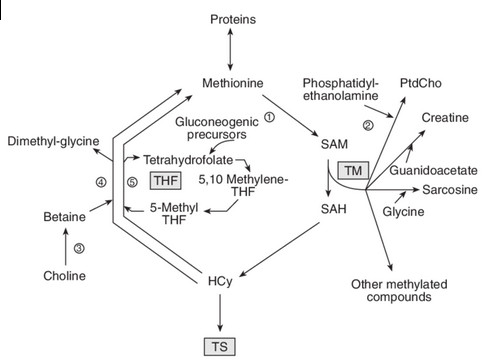
- Méthylation dépendant de l’acide folique (vit. B9) : Ce procédé reconverti l’homocystéine en méthionine, et aide à garder un taux faible d’homocystéine15. Trois nutriments sont requis pour en assurer le bon déroulement :
Acide folique (vit. B9) : Cette vitamine B est probablement le nutriment le plus important dans le maintien à des niveaux convenable du taux d’homocystéine16, 17, 18.
Vitamine B12 : Les végétariens manquent souvent de vitamine B12, ce qui peut entraîner une augmentation du taux d’homocystéine19, 20.
Riboflavine (vit. B2) : Bien que la riboflavine ne soit pas nécessaire à ce processus, elle peut avoir des effets de limitation sur l’homocystéine18, 21. - Méthylation indépendant de l’acide folique : Il s’agit d’un processus alternatif qui reconverti l’homocystéine en méthionine ou en diméthylglycine, ce qui permet de garder un taux d’homocystéine convenable15. Plusieurs nutriments sont requis pour assurer son bon fonctionnement :
Triméthylglycine ou choline (TMG) : Aussi appelée bétaïne, la triméthylglycine se trouve dans de nombreux aliments végétaux. Elle peut également être produite à partir de choline22, 23, 24. - Trans-sulfuration : Ce processus réduit le taux d’homocystéine en la transformant en gluthation (GSH), le principal anti-oxydant du corps humain et en acide aminé cystéine. Cela ne réduit pas le niveau de base d’homocystéine, mais peut en atténuer les piques après un repas. Cette étape est notamment possible grâce à l’intervention de multiples nutriments comme la vitamine B6, la sérine, le magnésium et plus particulièrement la glycine25.
Mécanismes
Les deux premières voies consisteront à reconvertir en méthionine, via la choline (vitamine du group B) (TMG) et les folates, en lui rajoutant le groupe méthyl qu’elle a perdue dans sa conversion en SAM. On revient donc ici à la méthionine de départ. Une consommation excessive de méthionine peut donc causer une augmentation du taux d’homocystéine dans le sang, surtout chez les personnes qui manque de certains nutriments comme l’acide folique6. Les aliments les plus riches en acide folique(vit. B9) sont les foies d'animaux (agneau, veau, volaille), les légumes à feuilles vertes (épinards, cresson, mâche, salade, oseille, chicorée, choux de Bruxelles), les légumineuses ( pois chiches, petits pois, lentilles…), les fruits secs à coque (amandes, noix, noisettes). La riboflavine (vit. B2) est plus abondante dans les aliments d’origine animale : produits laitiers, abats, œufs, poissons et viandes. Parmi les végétaux, les légumes de couleur verte en sont relativement riches.Pourquoi un taux élevé en homocystéine est problématique ?
L’homocystéine est très réactive dans le corps, ce qui la rend potentiellement néfaste en grande quantité. Un taux élevé d’homocystéine a d’ailleurs été lié à plusieurs maladies chroniques, comme les maladies cardiaques7, 8. Il n’existe actuellement pas de preuve concrète qu’un taux élevé d’homocystéine peut, de lui-même, causer des maladies cardiaques. Il peut s’agir simplement d’un facteur de risque indirect, statistiquement associé à la cause réelle. Quelques études ont démontré que réduire le taux d’homocystéine grâce à l’acide folique ou d’autres vitamines B après un infarctus ne diminue pas la fréquence d’épisodes récurrents au niveau du coeur ou du système circulatoire10, 11, 12. De plus, des méta-analyses ont découvert que réduire le taux d’homocystéine avait peu, voire pas d’effet sur de futures occurrences de maladies cardiaques, ou sur les risques de décès13, 14. On sait également que l’hyperhomocystéinémie est considérée comme un facteur de risque des maladies neurodégénératives. Toutefois, l’implication de l’homocystéine dans le mécanisme physiopathologique de ces affections, notamment dans la maladie d’Alzheimer, reste incertaine. L’hyperhomocystéinémie modérée, pouvant être liée à un déficit en vitamines B6, B12 et acide folique, est responsable d’un effet toxique sur les neurones de l’hippocampe par activation des récepteurs N-Methyl-D-Aspartate (NMDA). En effet, si la supplémentation vitaminique a largement prouvé son efficacité sur la réduction des concentrations plasmatiques d’homocystéine, les études actuelles ne mettent pas en évidence l’effet bénéfique de cette supplémentation en termes de réduction du risque de déclin cognitif et de démence40.Trop de méthionine donnera trop de SAM et ainsi enclenchera de l’hyperméthylation. Pour éviter cela, on peut faire appel à un autre acide aminé, la glycine, qui jouera comme un convertisseur tampon en dégradant la SAM en SAH.
En somme, plus nous consommons de méthionine plus nous avons besoin de glycine pour tamponner les excès de SAM.
Quelles sont les conséquences d’une alimentation carencée ?
Si les nutriments tampons de l'homocystéine venait à manquer, l’intégralité du cycle s’en trouverait perturbé et potentialiserait une augmentation de l’homocystéine, et donc tous les effets délétères qu’elle pourrait engendrer.Une carence en vitamine B12 empêche le recyclage de l’homocystéine, bloquant ainsi le bon déroulement des processus de méthylation. Les végétariens (et à fortiori les végétaliens) chez qui ce type de carence peut régulièrement être constatée35, 36, devraient donc être particulièrement vigilants sur cet aspect. Les personnes manquant d’acide folique et de riboflavine (vit. B2) peuvent consommer des compléments de vitamine B6 pour réduire leur taux d’homocystéine20, 26.
Mais les omnivores ne sont pas en reste, car leurs diètes habituelles sont souvent déficitaires en deux nutriments essentiels à ce processus : les folates, mais aussi et surtout la glycine. En effet, le rôle de la glycine est de transformer l’excès d’homocystéine en glutathion, ainsi que de tamponner l’excès de méthionine. De ce fait, plus on consomme de la viande, et surtout de la viande maigre, plus nos besoins en glycine augmentent (étant donné que la viande contient beaucoup de méthionine, l’essentiel de la glycine va être utilisée pour tamponner l’excès qui provient de cette consommation). Or, la glycine se trouvant essentiellement sous forme de collagène dans la peau et les os (qui ne sont plus tellement consommés de nos jours), les carences en glycine sont extrêmement courantes. La glycine n’est pas un acide aminé essentiel. Cela signifie qu’il ne nous est pas nécessaire de nous en procurer via notre régime alimentaire pour survivre. En revanche, on trouve de la glycine en grande quantité dans la peau, les tissus conjonctifs, les ligaments, les tendons, le cartilage et les os. Le corps peut d’ailleurs en produire lui-même à partir de l’acide aminé sérine27, 28. Cependant, les données suggèrent que la glycine synthétisée à partir de sérine n’est pas en mesure de satisfaire entièrement les besoins du corps. C’est pourquoi nous pouvons avoir besoin d’en consommer grâce aux aliments3, 4.
Est-ce que la consommation excessive de viande augmente t-elle le taux d’homocystéine ?
La question n’est pas clairement tranchée. Après avoir mangé un repas riche en protéines, ou pris des compléments de méthionine, le taux d’homocystéine peut augmenter en quelques heures. L’intensité de cette augmentation dépend des doses consommées9. Cependant, cette augmentation ne se produit que temporairement après un repas, et est tout à fait normale. En revanche, une augmentation du niveau de base d’homocystéine est un problème plus inquiétant. Pour augmenter le niveau de base d’homocystéine, il faut une forte dose de méthionine pure. On estime cette dose comme équivalente à 5 fois l’apport journalier normal en méthionine6, 28, 29, 30 alors que des doses plus faibles n’augmentent pas le niveau de base d’homocystéine31. Il n’existe pourtant pas de preuve concrète qu’un régime riche en viande de muscle augmente le taux de base d’homocystéine chez les personnes en bonne santé.Bien que l’homocystéine soit un produit du métabolisme de la méthionine, l’apport en méthionine alimentaire n’est généralement pas la cause d’une augmentation du niveau de base d’homocystéine. Les causes réelles d’une telle augmentation semblent relever plutôt d’une inhabilité du corps à garder le niveau d’homocystéine à un taux convenable. Cela inclut le manque de nutriments, un style de vie néfaste, des maladies et la génétique.
Conclusion
Nous avons vu que la méthionine est essentielle au bon fonctionnement de l’organisme et qu’elle ne peut être apportée que par l’alimentation. Pour autant, sa consommation en excès entraîne des effets délétères réels. Nous voyons ici encore que rien n’est binaire. La méthionine n’est ni bonne ni mauvaise, elle juste nécessaire. Comme toujours en nutrition, il y a un optimum qui doit être en dessous d’un niveau de risque et à partir duquel nous pourrons avoir des bénéfices.Les sources protéines de haute qualité apportent une quantité importante de méthionine dont une partie devra être "retraitée" métaboliquement. La supplémentation en glycine peut être une solution à ne pas négliger chez les gros consommateurs de ces protéines.
Conflit d'intérêts
Le.s auteur.s déclare.nt n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Bibliographie
[1] https://ndb.nal.usda.gov/ndb/search
[2] J Biol Chem. 2002 Feb 8;277(6):4223-31. Epub 2001 Nov 9. Mapping the ligand-binding sites and disease-associated mutations on the most abundant protein in the human, type I collagen. Di Lullo GA1, Sweeney SM, Korkko J, Ala-Kokko L, San Antonio JD.
[3] J Biosci. 2009 Dec;34(6):853-72. A weak link in metabolism: the metabolic capacity for glycine biosynthesis does not satisfy the need for collagen synthesis. Meléndez-Hevia E1, De Paz-Lugo P, Cornish-Bowden A, Cárdenas ML.
[4] J Anim Sci Biotechnol. 2014 Jun 14;5(1):34. doi: 10.1186/2049-1891-5-34. eCollection 2014. Dietary requirements of synthesizable amino acids by animals: a paradigm shift in protein nutrition. Wu G
[5] Hypertension. 2001 Nov;38(5):1217-21. Hyperhomocysteinemia in liver cirrhosis: mechanisms and role in vascular and hepatic fibrosis. García-Tevijano ER1, Berasain C, Rodríguez JA, Corrales FJ, Arias R, Martín-Duce A, Caballería J, Mato JM, Avila MA.
[6] Am J Clin Nutr. 2005 Sep;82(3):553-8. A high-protein diet increases postprandial but not fasting plasma total homocysteine concentrations: a dietary controlled, crossover trial in healthy volunteers. Verhoef P1, van Vliet T, Olthof MR, Katan MB.
[7] BMJ. 2002 Nov 23;325(7374):1202. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. Wald DS1, Law M, Morris JK
[8] Nutr Metab Cardiovasc Dis. 2006 Mar;16(2):113-20. Epub 2005 Nov 2. High dietary methionine intake increases the risk of acute coronary events in middle-aged men. Virtanen JK1, Voutilainen S, Rissanen TH, Happonen P, Mursu J, Laukkanen JA, Poulsen H, Lakka TA, Salonen JT.
[9] Arterioscler Thromb Vasc Biol. 1999 Dec;19(12):2922-7. Physiological increments in plasma homocysteine induce vascular endothelial dysfunction in normal human subjects. Chambers JC1, Obeid OA, Kooner JS.
[10] N Engl J Med. 2006 Apr 13;354(15):1578-88. Epub 2006 Mar 12. Homocysteine lowering and cardiovascular events after acute myocardial infarction. Bønaa KH1, Njølstad I, Ueland PM, Schirmer H, Tverdal A, Steigen T, Wang H, Nordrehaug JE, Arnesen E, Rasmussen K; NORVIT Trial Investigators
[11] N Engl J Med. 2006 Apr 13;354(15):1567-77. Epub 2006 Mar 12. Homocysteine lowering with folic acid and B vitamins in vascular disease. Lonn E1, Yusuf S, Arnold MJ, Sheridan P, Pogue J, Micks M, McQueen MJ, Probstfield J, Fodor G, Held C, Genest J Jr; Heart Outcomes Prevention Evaluation (HOPE) 2 Investigators.
[12] BMJ. 2012 Jun 13;344:e3533. doi: 10.1136/bmj.e3533. The effect of folic acid based homocysteine lowering on cardiovascular events in people with kidney disease: systematic review and meta-analysis. Jardine MJ1, Kang A, Zoungas S, Navaneethan SD, Ninomiya T, Nigwekar SU, Gallagher MP, Cass A, Strippoli G, Perkovic V
[13] Arch Intern Med. 2010 Oct 11;170(18):1622-31. doi: 10.1001/archinternmed.2010.348. Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals. Clarke R1, Halsey J, Lewington S, Lonn E, Armitage J, Manson JE, Bønaa KH, Spence JD, Nygård O, Jamison R, Gaziano JM, Guarino P, Bennett D, Mir F, Peto R, Collins R; B-Vitamin Treatment Trialists' Collaboration
[14] PLoS Med. 2012 Feb;9(2):e1001177. doi: 10.1371/journal.pmed.1001177. Epub 2012 Feb 21. Homocysteine and coronary heart disease: meta-analysis of MTHFR case-control studies, avoiding publication bias. Clarke R1, Bennett DA, Parish S, Verhoef P, Dötsch-Klerk M, Lathrop M, Xu P, Nordestgaard BG, Holm H, Hopewell JC, Saleheen D, Tanaka T, Anand SS, Chambers JC, Kleber ME, Ouwehand WH, Yamada Y, Elbers C, Peters B, Stewart AF, Reilly MM, Thorand B, Yusuf S, Engert JC, Assimes TL, Kooner J, Danesh J, Watkins H, Samani NJ, Collins R, Peto R; MTHFR Studies Collaborative Group
[15] J Nutr. 2007 Feb;137(2):311-4. New insights into the regulation of methyl group and homocysteine metabolism. Williams KT1, Schalinske KL
[16] BMJ. 1998 Mar 21;316(7135):894-8. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. Homocysteine Lowering Trialists' Collaboration
[17] Eur J Clin Nutr. 2002 Aug;56(8):748-54. Assessment of three levels of folic acid on serum folate and plasma homocysteine: a randomised placebo-controlled double-blind dietary intervention trial. Venn BJ1, Mann JI, Williams SM, Riddell LJ, Chisholm A, Harper MJ, Aitken W, Rossaak JI.
[18] Semin Vasc Med. 2005 May;5(2):110-23. Dietary determinants of plasma homocysteine concentrations. Verhoef P1, de Groot LC
[19] Br J Nutr. 2013 Mar 14;109(5):785-94. doi: 10.1017/S000711451200520X. Epub 2013 Jan 8. Plasma total homocysteine status of vegetarians compared with omnivores: a systematic review and meta-analysis. Obersby D1, Chappell DC, Dunnett A, Tsiami AA
[20] Am J Clin Nutr. 2004 Sep;80(3):641-8. Changes in basal and postmethionine load concentrations of total homocysteine and cystathionine after B vitamin intervention. Bleie Ø1, Refsum H, Ueland PM, Vollset SE, Guttormsen AB, Nexo E, Schneede J, Nordrehaug JE, Nygård O
[21] Am J Clin Nutr. 2003 Jun;77(6):1352-60. Riboflavin (vitamin B-2) and health. Powers HJ
[22] Nutr Metab Cardiovasc Dis. 2009 Dec;19(11):767-73. doi: 10.1016/j.numecd.2009.01.004. Epub 2009 Apr 5. Dietary and supplementary betaine: effects on betaine and homocysteine concentrations in males. Atkinson W1, Slow S, Elmslie J, Lever M, Chambers ST, George PM
[23] J Nutr. 2003 May;133(5):1291-5. Betaine supplementation lowers plasma homocysteine in healthy men and women. Steenge GR1, Verhoef P, Katan MB
[24] Am J Clin Nutr. 2005 Jul;82(1):111-7. Choline supplemented as phosphatidylcholine decreases fasting and postmethionine-loading plasma homocysteine concentrations in healthy men. Olthof MR1, Brink EJ, Katan MB, Verhoef P
[25] Am J Clin Nutr. 2000 Dec;72(6):1535-41. Primed, constant infusion with [2H3]serine allows in vivo kinetic measurement of serine turnover, homocysteine remethylation, and transsulfuration processes in human one-carbon metabolism. Gregory JF 3rd1, Cuskelly GJ, Shane B, Toth JP, Baumgartner TG, Stacpoole PW
[26] Am J Clin Nutr. 2001 Apr;73(4):759-64. Low-dose vitamin B-6 effectively lowers fasting plasma homocysteine in healthy elderly persons who are folate and riboflavin replete. McKinley MC1, McNulty H, McPartlin J, Strain JJ, Pentieva K, Ward M, Weir DG, Scott JM
[27] Biosci Biotechnol Biochem. 2006 Oct;70(10):2403-9. Epub 2006 Oct 7. Suppression of methionine-induced hyperhomocysteinemia by glycine and serine in rats. Fukada S1, Shimada Y, Morita T, Sugiyama K
[28] Am J Clin Nutr. 2004 Sep;80(3):674-9. Dietary serine and cystine attenuate the homocysteine-raising effect of dietary methionine: a randomized crossover trial in humans. Verhoef P1, Steenge GR, Boelsma E, van Vliet T, Olthof MR, Katan MB
[29] Am J Clin Nutr. 2002 Dec;76(6):1202-6. Effect of protein and methionine intakes on plasma homocysteine concentrations: a 6-mo randomized controlled trial in overweight subjects. Haulrik N1, Toubro S, Dyerberg J, Stender S, Skov AR, Astrup A
[30] Int J Vitam Nutr Res. 2001 Jan;71(1):82-6. Effect of supplemental methionine on plasma homocysteine concentrations in healthy men: a preliminary study. Ward M1, McNulty H, McPartlin J, Strain JJ, Weir DG, Scott JM
[31] Clin Chim Acta. 1990 Nov 15;192(1):69-76. The effect of excess daily methionine intake on plasma homocysteine after a methionine loading test in humans. Andersson A1, Brattström L, Israelsson B, Isaksson A, Hultberg B
[32] Am J Clin Nutr. 2011 Sep;94(3):847-53. doi: 10.3945/ajcn.110.003483. Epub 2011 Jul 27. Deficient synthesis of glutathione underlies oxidative stress in aging and can be corrected by dietary cysteine and glycine supplementation. Sekhar RV1, Patel SG, Guthikonda AP, Reid M, Balasubramanyam A, Taffet GE, Jahoor F
[33] http://onlinelibrary.wiley.com/doi/10.1111/j.1479-8425.2007.00262.x/abstract
[34] https://www.inserm.fr/information-en-sante/dossiers-information/epigenetique
[35] Ann Nutr Metab. 2000;44(3):135-8. Homocysteine levels in vegetarians versus omnivores. Krajcovicová-Kudlácková M1, Blazícek P, Kopcová J, Béderová A, Babinská K.
[36] Br J Nutr. 2013 Mar 14;109(5):785-94. doi: 10.1017/S000711451200520X. Epub 2013 Jan 8. Plasma total homocysteine status of vegetarians compared with omnivores: a systematic review and meta-analysis. Obersby D1, Chappell DC, Dunnett A, Tsiami AA.
[37] Eur J Intern Med. 2001 Feb;12(1):43-47. Hyperhomocysteinemia in bodybuilders taking anabolic steroids.
Ebenbichler CF1, Kaser S, Bodner J, Gander R, Lechleitner M, Herold M, Patsch JR. https://www.ncbi.nlm.nih.gov/pubmed/11173010
[38] Effects of Anabolic Androgenic Steroids Abuse on Homocysteine Levels in Bodybuilders Athletes Sabah N. AL-Thamir, Aymen A. Bash College of Pharmacy / University of Babylon https://www.researchgate.net/publication/311376939_Effects_of_Anabolic_Androgenic_Steroids_Abuse_on_Homocysteine_Levels_in_Bodybuilders_Athletes
[39] Medicina dello Sport 2008 September;61(3):347-56 Copyright © 2008 EDIZIONI MINERVA MEDICA Consumption of protein supplements and homocysteine concentrations in persons practicing physical activity in gyms. Sales Gomes G. 1, Ribeiro Garlipp M. 2, Carvalho Degiovanni G. 2, Vannucchi H. 2, Garcia Chiarello P. 2, Afonso Jordao A. 2 1 Biomedical Investigation, FMRP/USP, Ribeirão Preto, San Paolo, Brazil 2 Department of Nutrition and Metabolism, FMRP/USP, Ribeirão Preto, San Paolo, Brazil https://www.researchgate.net/publication/286221420_Consumption_of_protein_supplements_and_homocysteine_concentrations_in_persons_practicing_physical_activity_in_gyms
[40] Pathol Biol (Paris). 2013 Oct;61(5):184-92. doi: 10.1016/j.patbio.2012.04.003. Epub 2012 May 29. [Homocysteine, vitamin B-12, folic acid and the cognitive decline in the elderly]. Smach MA1, Naffeti S, Charfeddine B, Ben Abdallah J, Othmen LB, Letaef A, Limem K.
Les derniers articles du blog !
Tous les articles liés à "Rôle de la méthionine dans le processus de vieillissement"

La sarcopénie, l'âge et la perte de muscle
La sarcopénie se définit comme un processus de perte progressive et générale de la force et de la masse musculaire. Les études s'accordent pour dire que la dégénerescence musculaire survient dès l'âge de 30 ans à raison d'une perte musculaire moyenne pouvant varier de 3 à 8% tous les dix ...
